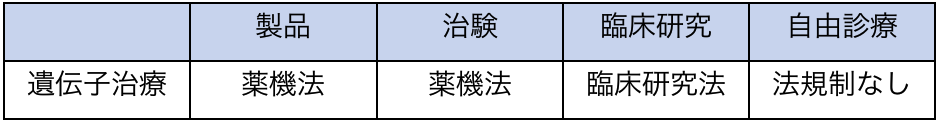
日本では、遺伝子治療製品も「医薬品、医療機器等の品質、有効性、安全性の確保等に関する法律」(以下、薬機法)において「再生医療等製品」に分類されていることから、遺伝子治療の法規制について述べる。
遺伝子治療は、薬機法においては、再生医療等製品に分類されており、承認製品及び治験とも、薬機法の規制を受ける。(別ウインドウで開きます)
しかし、「再生医療等の安全性の確保等に関する法律」(以下、再生医療安全性確保法)は、自由診療並びに臨床研究として再生医療を提供することを規制する法律ではあるが、その対象は特定細胞加工物(細胞加工物のうち、再生医療等製品ではないもの)に限定されており、遺伝子治療は含まれない。
遺伝子治療の臨床研究に対する規制は臨床研究法の範疇となっており、事前規制が機能している。
一方で、自由診療を規制する法律は存在せず、「野放し」状態にある。規制当局もこの問題は認識しており、法規制導入の議論が行われている。
遺伝子治療においては、上述したものとは別の法規制も存在する。
「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律」(以下、カルタヘナ法)は、生物の多様性に関する条約(Convention on Biological Diversity)のバイオセーフティに関するカルタヘナ議定書を国内規制に落とし込むことを目的とした法律であるため、通称カルタヘナ法と呼ばれる。
カルタヘナ法は、遺伝子組み換え生物の使用を規制する法律であるが、遺伝子治療で用いられるウイルスベクターもカルタヘナ法の規制を受ける。
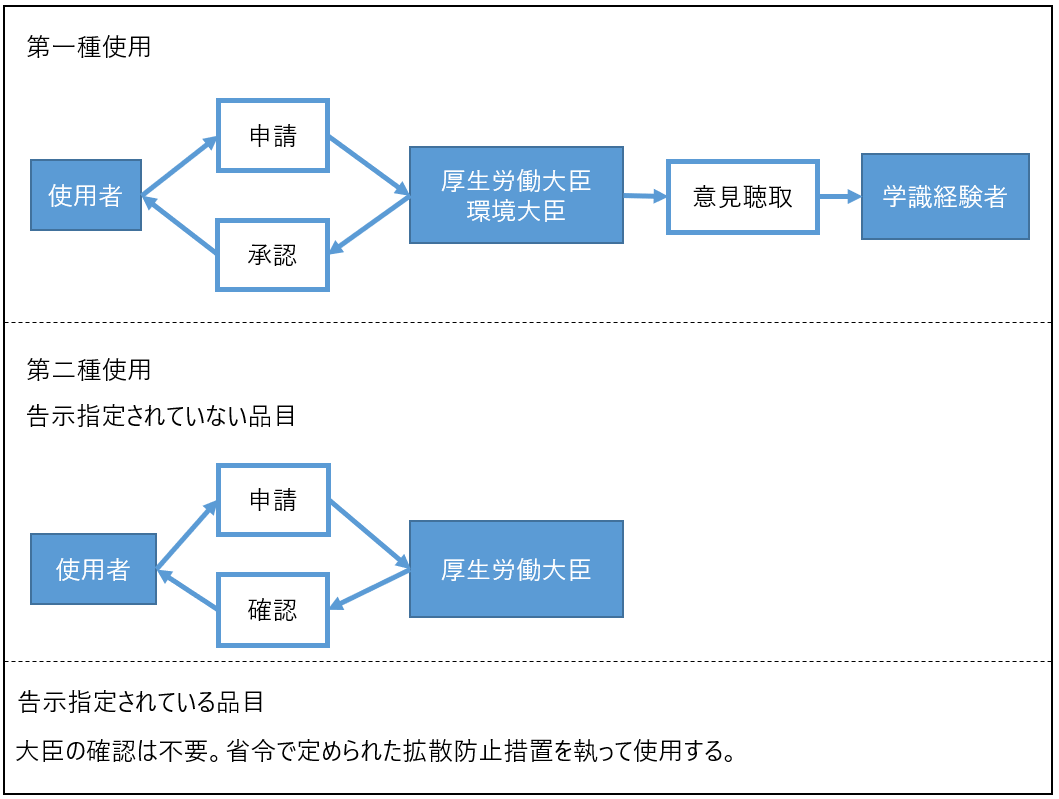
カルタヘナ法では、大気、水または土壌等の環境への拡散を防止する「第二種使用等」と大気、水または土壌等の環境への拡散を防止しない「第一種使用等」に分類される。治験や臨床研究のようなヒトへの投与においては、環境への拡散を完全には防止できないため、第一種使用に該当する。
一方で、工場や研究所等で、完全な拡散防止措置が取れる場合には第二種使用となる。
> 再生医療コラム:再生医療に関する法律「再生医療等安全性確保法における再生医療等技術の分類」(別ウインドウで開きます)
ヒトの遺伝子組み換え細胞はカルタヘナ法では遺伝子組み換え生物には該当しないと定義されている。
遺伝子を組み込まれたヒト細胞自体は法でいう遺伝子組み換え生物に該当しないため、CAR-Tのようなex vivoの遺伝子治療は、第一種使用には該当しない。
ただし、製造工程でのウイルスクリアランスが十分ではなく、製品中にウイルスベクターが残存している可能性が否定できない場合には、ウイルスベクターの混入があるものとして扱い、第一種使用となる。遺伝子導入プロセスでウイルスベクターを使用する場合には、カルタヘナ法の第二種使用に該当する。
第一種使用は、主務大臣及び環境大臣の承認が必要であり、第二種使用は主務大臣の確認が必要となる。